
Lise LECOINTRE
|
Carla SOUSA1, 3, Jade LEBRUNET1, 3, Estelle TROMELIN 1, 3, Jean LEVÊQUE1, 2, 3
1Service de Gynécologie, CHU Anne de Bretagne Hospices Civils de Rennes
2CRLCC Eugène Marquis
3UFR Médecine - Université de Rennes
Pourquoi arrêter le dépistage à 65 ans ?
Le dépistage du cancer du col de l’utérus en France est organisé de 25 à 65 ans, comportant une cytologie cervicale à 25 ans puis à 26 ans puis 3 ans plus tard en l’absence d’anomalies et se modifie à partir de 30 ans devenant virologique jusqu’à 65 ans avec une périodicité de 5 ans en l’absence d’anomalies. Le choix d’arrêter à 65 ans repose sur des arguments cliniques et médico-économiques :
- La prévalence de l’infection HPV et HPVhr (HPV haut risque) chute avec l’âge [1],
- Les corrélations entre anomalies cytologiques et test HPV qui se modifient à la ménopause avec moins d’anomalies chez les HPV+ et les HPV hr +, et en présence d’anomalies cytologiques une proportion plus importante d’HPV bas risque,
- L’impact hormonal de la ménopause sur les cellules de la zone de transformation exprimant fortement les récepteurs estrogéniques [2] et l’ascension vers l’endocol de la jonction la rendant potentiellement moins accessible à l’HPV [3],
- La présence d’un immunité naturelle (modeste puisqu’elle ne confère qu’un bénéfice de 30% de diminution des ré-infections par HPV16 dans une méta-analyse récente [4], qui augmente avec le temps,
- Enfin, argument en creux, le délai entre infection HPV et cancer invasif du col utérin de 15 à 20 ans chez des patientes françaises de 65 ans dont l’espérance de vie selon l’INSEE est de 23.1 ans en 2022.
Quand arrêter le dépistage ?
Les recommandations varient selon les pays et force est de reconnaître que la littérature est peu diserte sur la date d’arrêt (Tableau 1).
Des papiers récents confortent toutefois ces recommandations :
- Une étude cas (CCU) contrôle en population finlandaise montre qu’un test normal (majoritairement ici cytologique) diminue de 79% le risque de développer un CCU par rapport aux femmes non testées [5],
- une deuxième étude cas contrôle britannique montre une différence de 4.94 / 1 000 femmes en terme de risque de développer un CCU sur 25 ans entre les femmes dépistées entre 60-64 ans et non dépistées entre 50-59 ans (3.46 CCU / 1 000) et celles non dépistées entre 50-64 ans (8.40 CCU / 1 000 femmes) [6],
- enfin la série du Kaiser Permanente North California indique qu’après 3 co-tests négatifs dans les 10 ans le risque absolu de développer une lésion CIN2+ à 5 ans est de 0.0016% : les auteurs concluent que l’objectif “cancer zéro” est irréaliste et que le choix de la date d’arrêt du dépistage est un “choix sociétal” [7].
Tableau 1 : quelques recommandations nationales sur la date et les modalités d’arrêt du dépistage.
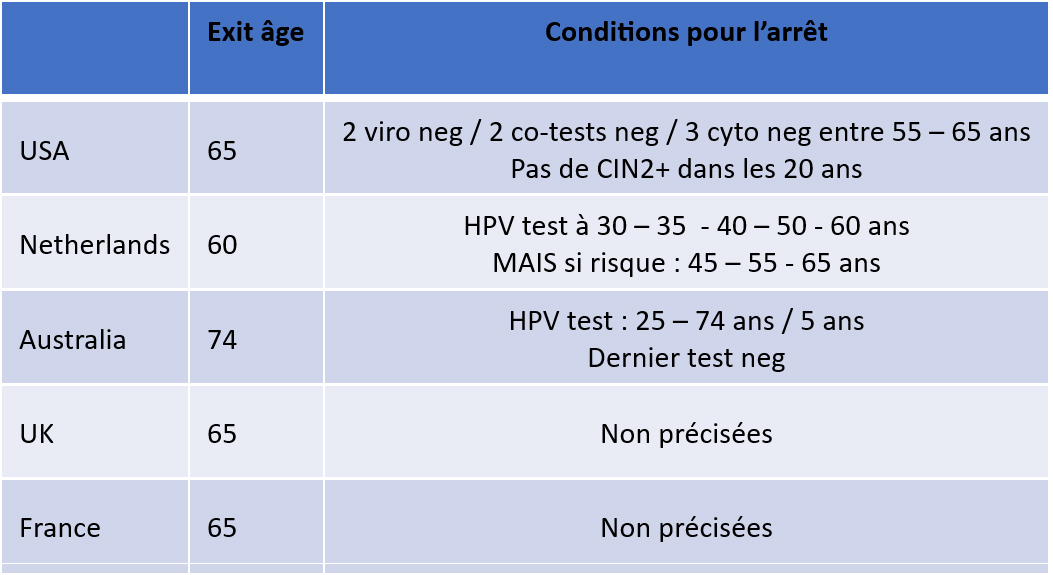
On peut donc estimer que lorsque les recommandations sont respectées (en particulier dans la tranche d’âge 50-65 ans), et que l’on dispose des preuves que les résultats sont négatifs, l’arrêt du dépistage organisé est une option raisonnable en termes médicaux et économiques.
Chez qui ne doit-on pas interrompre le dépistage ?
Force est de constater qu’existe un pic modeste mais bien réel d’incidence des cancers du col chez les plus de 60 ans constaté dans de nombreux pays [8] que l’on peut expliquer ainsi :
- les femmes de plus de 50 ans en particulier en France sont mal dépistées (et le Dépistage Organisé cherche à y pourvoir),
- existent des ré-infections liées aux modifications de la sexualité susceptibles d’évoluer avec le temps,
- et des ré-activations d’infections anciennes latentes mal appréhendées par les grandes études en population mais indéniables en pratique clinique quotidienne où l’immunité joue probablement un rôle majeur.
Certains cas particuliers méritent considération :
1. Les patientes ayant « un passé HPV » : elles sont clairement plus à risque de développer des lésions ultérieurement bien sur cervicales mais aussi extracervicales malignes et pré-malignes et devraient en conséquence continuer à être suivies [9],
2. Un 2ème pic de prévalence d’infection HPV est observé par des études en population dont l’origine peut être imputée aux ré-infections (on sait que la prévalence de l’infection HPV hr est constante chez l’homme avec l’âge [10], mais également aux ré-activations d’infections anciennes très tôt contractées comme évoqué dans l’étude portant sur la cohorte « HPV in Perimenopause Study » [11] ; le concept émergent d’histoire individuelle de l’infection HPV (par opposition à nos connaissances de l’histoire naturelle reposant sur des populations) sous-tend que l’infection HPV reste au moins chez nombre de patientes latente avec des charges virales indétectables avec nos instruments actuels mais susceptibles de se réveiller et provoquer alors des lésions [12],
3. Les patientes vivant avec le HIV : même si des études américaines récentes sont discordantes pour ce qui concerne le risque d’arrêter le dépistage chez des patientes de plus de 65 ans stabilisées [13, 14] , en France, les conclusions du « rapport Morlat » restent parfaitement d’actualité incitant à poursuivre le dépistage cytologique au-delà de 65 ans.
En conclusion
Le dépistage organisé du cancer du col de l’utérus en France est clairement un plus pour la santé des femmes en permettant à toutes d’accéder au dépistage avec une garantie de qualité : il doit être respecté. Restent des cas particuliers qui échappent à ces recommandations : les femmes non ou mal suivies, les femmes ayant un passé HPV pathologique et les femmes immuno-déprimées qui devraient bénéficier d’un suivi particulier et prolongé au-delà des 65 ans.
Les recommandations pour justes qu’elles soient, n’empêchent en rien une dépistage personnalisé, laissé à l’initiative du praticien et de sa patiente.
Références
[1] Dunne EF, Unger ER, Sternberg M, McQuillan G, Swan DC, Patel SS, Markowitz LE. Prevalence of HPV infection among females in the United States. JAMA. 2007;297:813-9.
[2] Remoue F, Jacobs N, Miot V, Boniver J, Delvenne P. High intraepithelial expression of estrogen and progesterone receptors in the transformation zone of the uterine cervix. Am J Obstet Gynecol. 2003;189:1660-5.
[3] Autier P, Coibion M, Huet F, Grivegnee AR. Transformation zone location and intraepithelial neoplasia of the cervix uteri. Br J Cancer. 1996;74:488-90.
[4] Yokoji K, Giguere K, Malagon T, Ronn MM, Mayaud P, Kelly H, et al. Association of naturally acquired type-specific HPV antibodies and subsequent HPV re-detection: systematic review and meta-analysis. Infect Agent Cancer. 2023;18:70.
[5] Kultalahti H, Heinavaara S, Sarkeala T, Pankakoski M. Effect of Test History at Ages 50-64 on Later Cervical Cancer Risk: A Population-based Case-control Study. Cancer Res Commun. 2023;3:1823-9.
[6] Castanon A, Green LI, Sasieni P. Impact of screening between the ages of 60 and 64 on cumulative rates of cervical cancer to age 84y by screening history at ages 50 to 59: A population-based case-control study. Prev Med. 2021;149:106625.
[7] Landy R, Schiffman M, Sasieni PD, Cheung LC, Katki HA, Rydzak G, et al. Absolute risks of cervical precancer among women who fulfill exiting guidelines based on HPV and cytology cotesting. Int J Cancer. 2020;146:617-26.
[8] Bosch FX, Lorincz A, Munoz N, Meijer CJ, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002;55:244-65.
[9] Wang J, Andrae B, Sundstrom K, Ploner A, Strom P, Elfstrom KM, et al. Effectiveness of cervical screening after age 60 years according to screening history: Nationwide cohort study in Sweden. PLoS Med. 2017;14:e1002414.
[10] Bruni L, Albero G, Rowley J, Alemany L, Arbyn M, Giuliano AR, et al. Global and regional estimates of genital human papillomavirus prevalence among men: a systematic review and meta-analysis. Lancet Glob Health. 2023;11:e1345-e62.
[11] Paul P, Hammer A, Rositch AF, Burke AE, Viscidi RP, Silver MI, et al. Rates of New Human Papillomavirus Detection and Loss of Detection in Middle-aged Women by Recent and Past Sexual Behavior. J Infect Dis. 2021;223:1423-32.
[12] Gravitt PE, Winer RL. Natural History of HPV Infection across the Lifespan: Role of Viral Latency. Viruses. 2017;9.
[13] Massad LS, Xie X, Minkoff HL, Michel KG, D'Souza G, Wang CC, et al. Frequency of high-grade squamous cervical lesions among women over age 65 years living with HIV. Am J Obstet Gynecol. 2021;225:411 e1- e7.
[14] Stewart KA, Allen SM, Chesnokova AE, Syed F, Levison JE. Incidence of abnormal cervical and vaginal cytology among women over age 65 years living with human immunodeficiency virus. Am J Obstet Gynecol. 2020;222:486 e1- e10.
|






